医药大健康服务
岛津(广州)检测技术有限公司,按照ISO/IEC 17025、RB/T 214和《检验检测机构资质认定管理办法》的要求建立全面质量管理体系,配置DB/CS版软件,参照GMP、GLP规范运行,并制定有符合CNAS和CMA相关认可认定要求的质量手册和程序文件,同时满足《中华人民共和国药品管理法》的执行操作规定,保证实验室活动的审计追踪、数据可靠与报告质量。
我们的优势:
►综合的服务领域
- 检测分析涵盖原料药、各类药品(创新药、仿制药、制剂、饮片、中成药、中药材、中药颗粒等)、 医药辅料、医药包材、医疗器械、医疗器械材料等
- 药物接触系统相容性与密封性研究
包材相容性服务:包装容器相容性研究、生产组件相容性研究、给药器具相容性研究
容器/内容物相互作用:可提取物、浸出物/迁移物研究
包装材料测试(玻璃、塑料、胶塞等):鉴别、限度测试、重金属、性能测试、水蒸气透过率、密封性测试
- 杂质研究
基因毒性杂质、元素杂质、有关物质、溶剂残留
- 处方逆向工程
原研制剂各组分定量分析、原料药的固态表征、制备工艺的确认
- 方法开发与验证
依照ICH指南或客户需求进行方法验证、药典方案的方法确认、稳定性测试方法的开发和验证、实验室间方法转移、方法再验证
- 稳定性研究
长期稳定性研究、影响因素试验、加速稳定性研究、ICH放置条件或其他指定要求
- 分析测试
理化测试、微生物测试、生物测试
- 药品及医疗器械注册
国内注册:创新药临床试验申请、创新药上市许可申请及上市后维护、仿制药上市许可申请及上市后维护、原料药登记、药用辅料和药包材登记
国际注册:制剂欧洲注册、欧盟CEP/COS申请、欧盟ASMF/EDMF文件制作、美国IND申请、美国NDA申请、美国ADNA申请、美国DMF文件制作、FDA工厂注册、自认证与NDC申请
- 一致性评价的药学研究服务(CMC)
文献调研、参比制剂/原料来源的确定、处方前研究确定原料药关键属性、确定关键指标的评价方法(含溶出的评价方法)、参比制剂和仿制药的质量全面对比、制剂处方与工艺优化开发研究、申报批次全面质量对比研究、稳定性考察与分析方法验证、仿制药质量标准的建立、技术转移、 申报资料撰写
-拥有岛津集团高科技分析和测试仪器
-全球一线品牌高配置仪器设备
►专业的技术团队
-高水平的仪器应用和研发能力
-丰富的检验检测及研发经验
►独家的个性化服务
-提供免费预研、仪器应用技术支持等服务
服务流程:

农残检测解决方案
2025年版《中国药典》中药农药残留检测全流程解决方案
导语
2025年3月25日,国家药监局、国家卫生健康委发布关于颁布2025年版《中华人民共和国药典》的公告。公告明确根据《中华人民共和国药品管理法》,2025年版《中华人民共和国药典》(以下简称《中国药典》)经第十二届药典委员会执行委员会全体会议审议通过,现予颁布,自2025年10月1日起施行。

在中药安全方面,针对中药材种植(养殖)、加工环节的外源性污染问题,2025年版《中国药典》构建起全链条风险防控体系。首次实施“禁用农药”与“使用农药”分类管理,禁用农药检测品种由2020年版《中国药典》的33种(55个单体)扩展至47种(72个单体),并在2025年版《中国药典》新增了枸杞子、人参、三七等14种药材中35种登记农药共计64个“使用农药”的最大残留限量标准。在检测方法上,2341农药残留量测定法新增“第六法 相关药材及饮片品种中农药多残留测定法”和“第七法 药材及饮片中二硫代氨基甲酸盐类农药残留量测定法”。
针对新版药典标准发布,岛津技术团队做了研读,开展了标准复现实验工作,制定了全流程解决方案,助力行业相关单位开展标准扩项和建立检测能力,应对新标准实施准备工作。
全流程解决方案
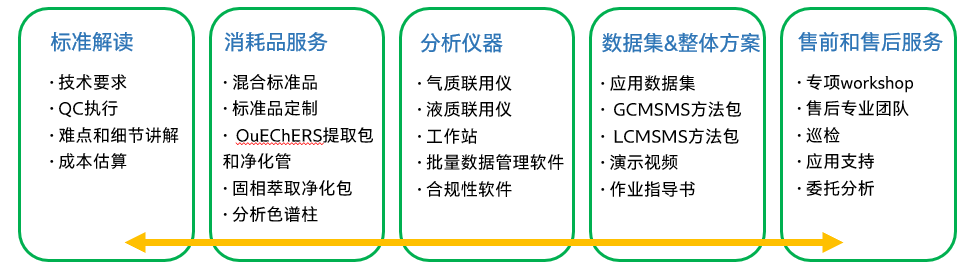
分析仪器
禁用农药项目大部分化合物的“报告限”为10~100μg/kg,对质谱仪器灵敏度提出了高要求。岛津气质和液质联用仪通过多重技术确保高灵敏度,助力禁用农残痕量级浓度的检测。
性能优异、便捷操作、良好的稳定性与抗污染能力


GC-GC-MS/MS LC-MS/MS

 岛津实验器材
岛津实验器材  岛津中国
岛津中国